光动力疗法(PDT)是光敏剂在激光辐照下将氧气转变为毒性的活性氧的一种治疗方法,因其非侵入性、高效可控等特性,在肿瘤治疗领域潜力巨大。而肿瘤乏氧状态和酸性的微环境,导致了不可逆性的癌细胞转移和低氧相关的治疗抵抗。虽然已有很多研究旨在提高肿瘤微环境内的氧气含量,但其治疗效果往往不尽如人意。因此,开发出具有氧气调节且抑癌效应显著的纳米平台迫在眉睫。
为了实现乏氧肿瘤的高效治疗,我院高丰雷副教授团队联合复旦大学附属华山医院关明教授设计并构建了一种修饰了靶向P-PEG-RGD聚合物的智能纳米调节器,用于乏氧肿瘤的多模态治疗。如图1所示,该纳米调节器R-NCNP主要有三部分构成:1)介孔硅负载的氮掺杂石墨烯量子点(N-GQD@HMSN)作为核心结构,在两种波长激光(630、980 nm)辐照下,实现了协同的光热治疗和光动力治疗。2)介孔氮化碳(C3N4)层包覆于核心结构上,形成了特殊的壳-壳-芯结构。这C3N4层不仅能够快速分解微环境的内源性水分子产生大量氧气,而且其本身可以作为高效的光敏剂,同步放大单线态氧的含量继而增强光动力治疗效果。3)靶向P-PEG-RGD聚合物的修饰,可以直接靶向于乏氧的肿瘤部位,有效解决了肿瘤积累不足、癌细胞穿透能力差和正常组织的毒性等难题,从而实现了肿瘤的特异性诊断和治疗。

图1. 智能R-NCNP纳米调节器的制备、光解水机制以及光热-光动力协同治疗乏氧肿瘤的示意图。
该团队首先通过一系列体外实验对这种纳米调节器的性能进行了表征测试。研究发现,R-NCNP和NCN两种纳米调节器在630 nm激光辐照下,均能有效分解水分子产生氧气。但R-NCNP组氧气浓度的升高却低于NCN组,主要由于修饰聚合物中photofrin光敏成分消耗了部分氧气(图2)。接着,在细胞内的研究发现,αvβ3整合素受体介导了更多的纳米调节器进入肿瘤细胞,提高了靶向肿瘤细胞的累积量,同时氮化碳提高了氧气含量和改善了乏氧状态,继而使调节器中的三种光敏成分同时被激活,最大限度地放大了单线态氧的产生。
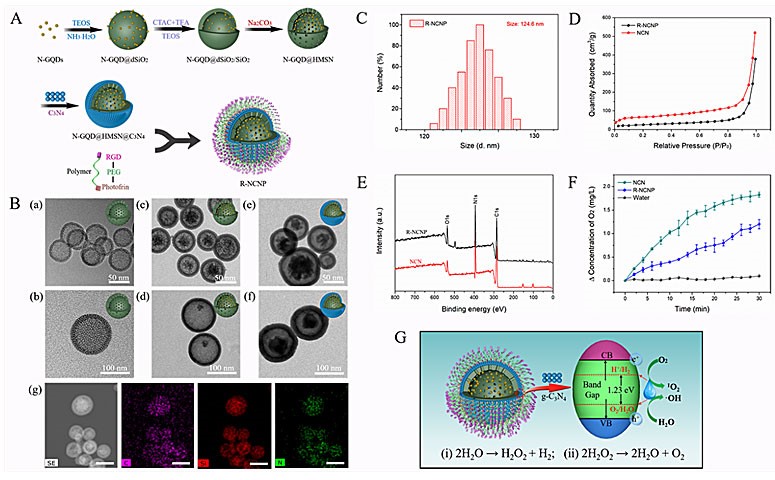
图2. 纳米调节器的制备和表征,A)合成方法示意图,B)投射电镜图和EDS分析,C)粒径分布,D)氮吸附测试,E)X射线光电子能谱,F-G)体外氧气产生和光解水的机制
同时,团队研究发现,由于氮化碳光解水效应所持续产生的氧气气泡,反射超声光束并引起组织阻抗失衡,这导致超声回波信号的连续放大(图3)。R-NCNP调节器本身其中空的特性,进一步增强了超声成像的信号。另外,氮掺杂石墨烯量子点本身存在的荧光示踪特性和光热效能(图4),实现了高精度、高空间分辨率和高灵敏度的超声/荧光/光热的多模态成像,这不仅增加了癌症诊断的精确性,并达到了治疗效果的实时监控。
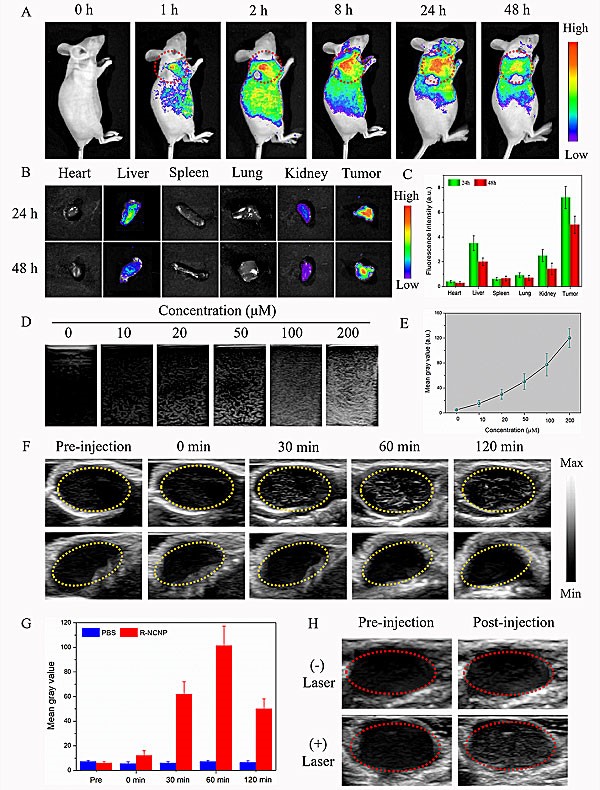
图3. 多模态成像,A) 不同时间点裸鼠肿瘤部位的荧光成像结果,B)R-NCNP纳米调节器注射后24小时和48小时,不同组织和肿瘤荧光成像的差异,C)荧光强度的定量分析,D-E)体外超声信号,F) 不同时间点裸鼠肿瘤部位的超声成像结果,G)超声灰度值的定量分析,H)有无激光条件下对超声信号强度的影响
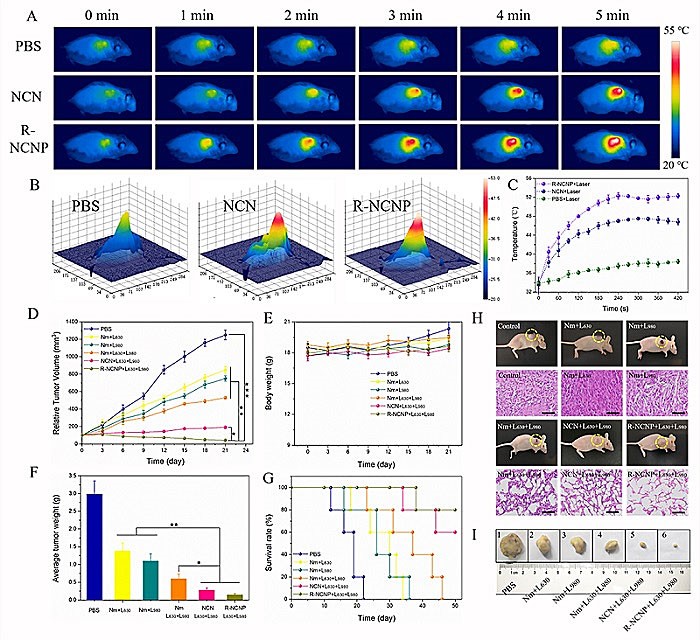
图4. A)不同时间肿瘤部位的光热成像,B-C)温度变化定量分析,D)相对肿瘤体积变化,E)身体重量变化,F)平均肿瘤重量,G)生存曲线,H-I)肿瘤治疗后的变化和组织切片
该团队以4T1负荷瘤的裸鼠为肿瘤模型,通过多模态成像跟踪肿瘤的生长情况,定量及定性分析表明,R-NCNP纳米调节器显著抑制了肿瘤的生长。生存曲线进一步阐明,R-NCNP治疗组小鼠的生存周期明显延长。因此,此研究工作实现了该纳米调节器光解水以改善肿瘤低氧、多模态靶向成像、协同的光热、光动力治疗功能在肿瘤动物模型中运用的有效性。
这种多功能纳米调节器以其独特的“高效、靶向、多模态成像”优势,有效实现了对肿瘤组织的精准打击和正常组织的有效保护,为临床耐药和晚期肿瘤的精准治疗提供了可能,为精准医疗的临床应用提供的一个新的借鉴和启示,研究工作得到了国家自然科学基金的支持。
这一成果近期发表在纳米领域国际权威学术期刊《ACS Nano》上(IF 13.903),文章第一作者是德国亚琛工业大学医学院博士研究生张星,高丰雷副教授和关明教授是该论文的共同通讯作者。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.9b08737#



