人体内水分约占体重的70%,维持精准的水盐平衡对生命健康至关重要。作为调控水盐平衡的“核心开关”,血管加压素V2受体(Vasopressin 2 receptor, V2R)不仅掌管着水分的重吸收,更是治疗低钠血症、尿崩症和心衰水肿等疾病的重要药物靶点。然而,目前临床使用的V2R拮抗类药物存在明显局限:托伐普坦潜藏肝毒性风险,考尼伐普坦则因同时作用于该家族其他亚型V1aR而缺乏精准靶向性。
近日,我院郭栋教授团队与临港实验室蒋轶团队和中国科学院上海药物所徐华强团队合作共同解析了V2R分别与两种临床拮抗药物——托伐普坦和考尼伐坦结合的高分辨率冷冻电镜结构(图1)。该研究系统揭示了V2R识别拮抗剂的精细分子机制,为开发新一代靶向V2R的药物奠定了关键结构基础,该研究成果于2025年11月4日发表于Nature Communications杂志,题为:Structural insights into antagonist recognition by the vasopressin V2 receptor。
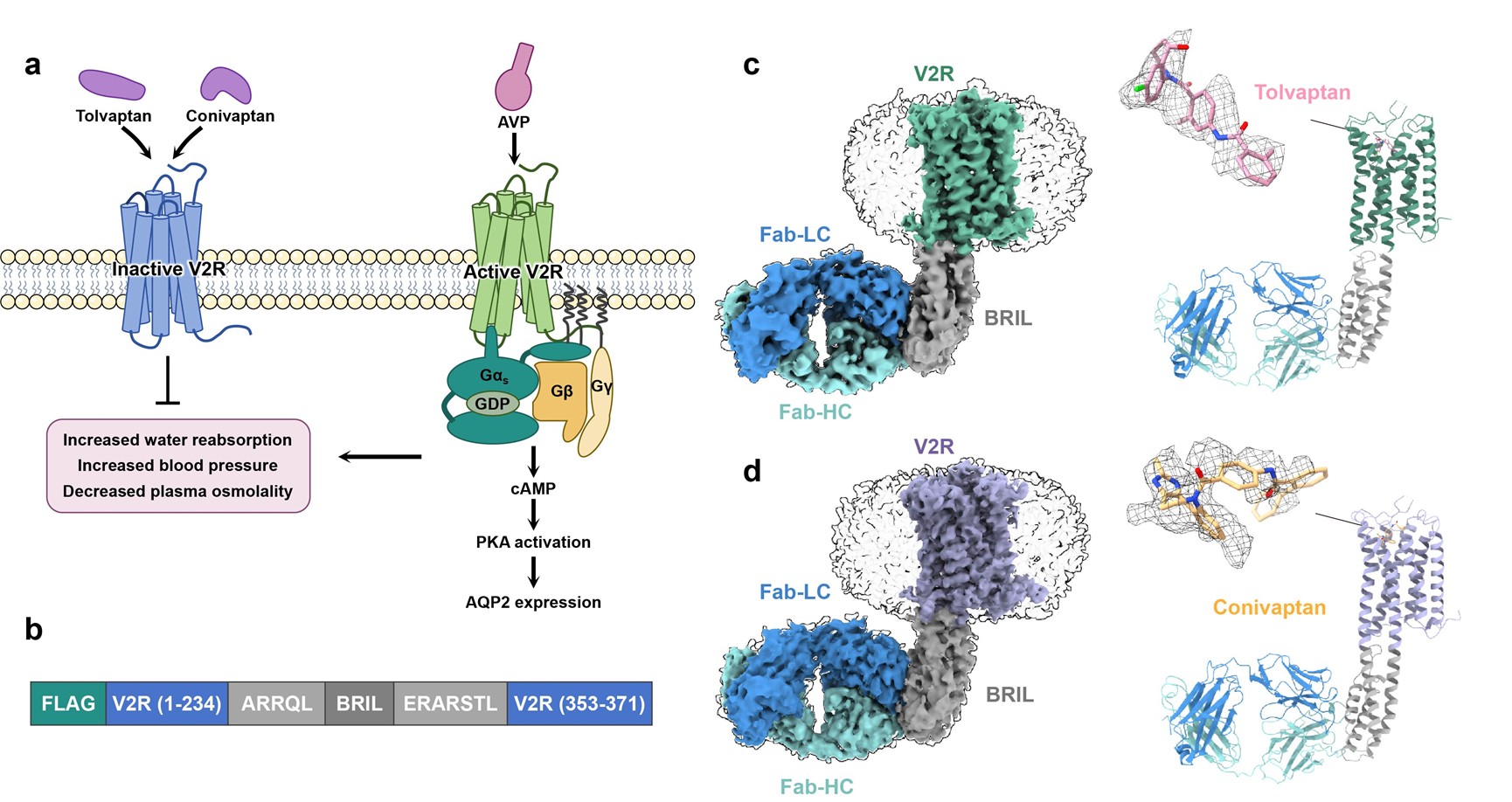
图1. V2R与托伐普坦及考尼伐坦结合的冷冻电镜结构
研究发现,托伐普坦和考尼伐坦在V2R的正构结合口袋中呈现出截然不同的结合模式。托伐普坦以“深度插入”的方式占据口袋,其苯并氮䓬基团(A 区)和甲基苯基基团(B 区)与V2R的TM3、TM5和TM6等区域的疏水残基形成稳定相互作用,同时通过氢键进一步增强结合稳定性(图2)。
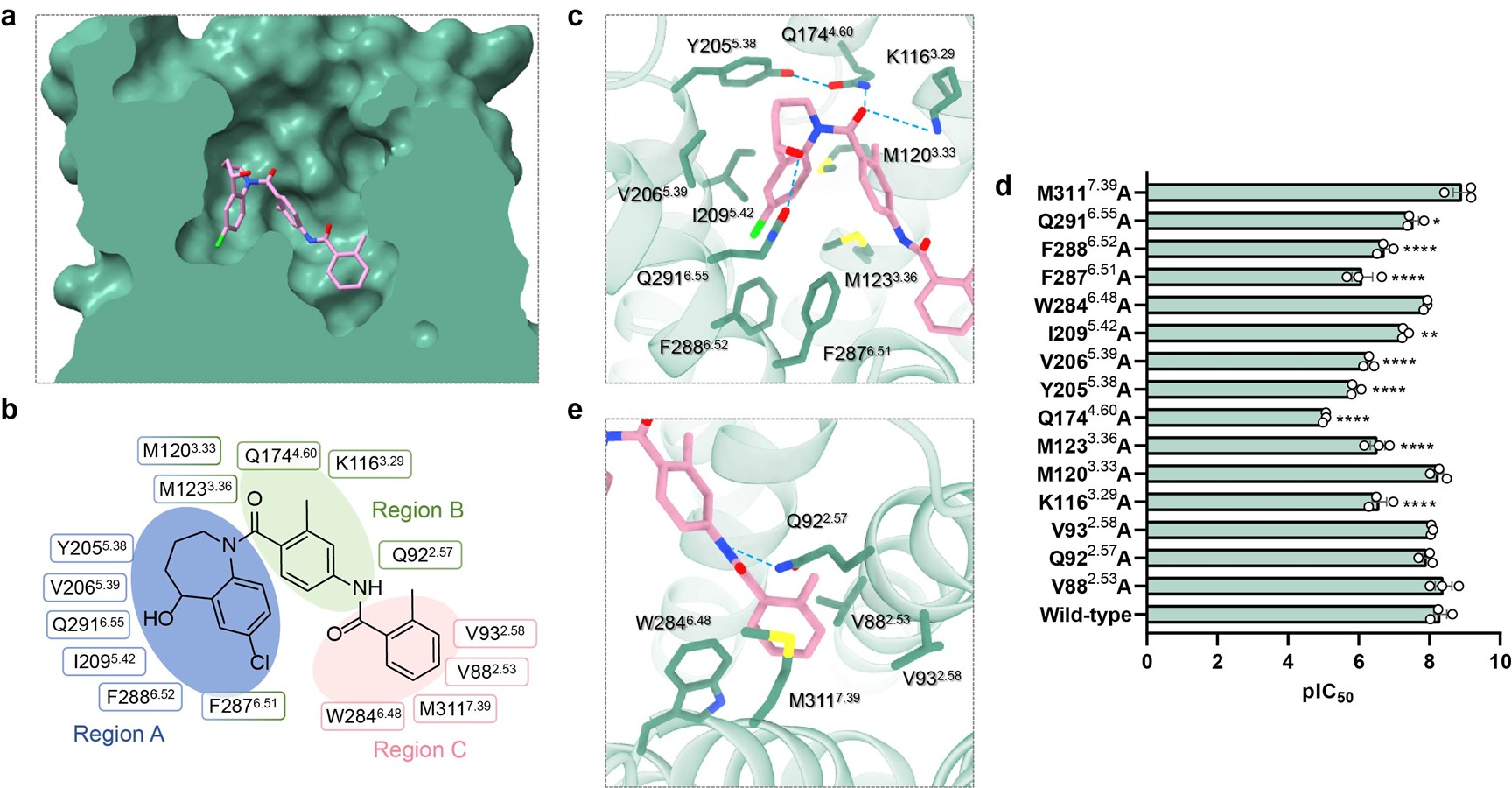
图2. 托伐普坦与V2R的识别机制
与托伐普坦不同的是,考尼伐普坦以“浅层结合”的方式存在于V2R口袋中。其苯并咪唑并氮䓬基团(A 区)靠近托伐普坦的对应区域,但苯环(B 区)和联苯(C 区)则朝向细胞外环 1(ECL1),且联苯基团与ECL1的F105残基形成π-π相互作用,这一独特作用对考尼伐坦的活性至关重要(图3)。
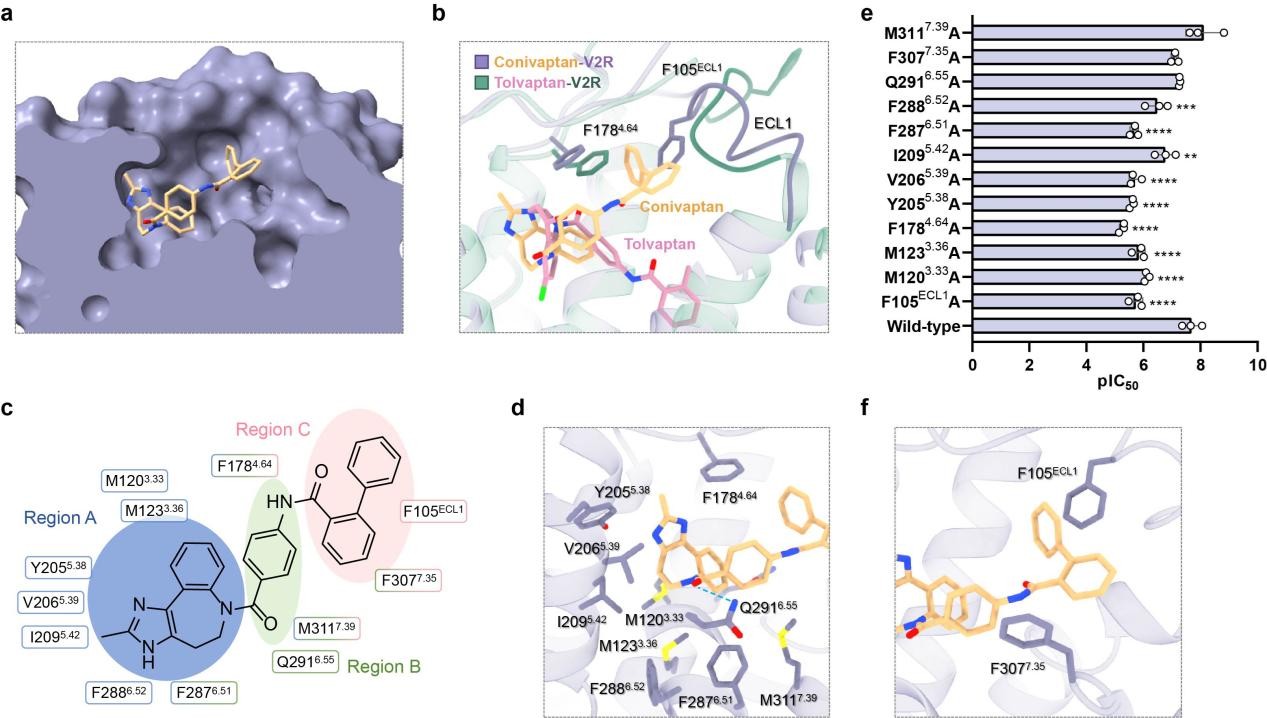
图3.考尼伐普坦与V2R的识别机制
研究团队进一步发现了一种依赖TM7螺旋构象的V2R拮抗机制。在活性状态下,血管加压素(Vasopressin, AVP)与V2R结合会导致TM7特定区域螺旋结构扭曲,从而激活受体;而拮抗剂结合后,可通过占据正构结合口袋,空间上阻碍AVP与TM7关键区域的相互作用,维持TM7螺旋的连续性,阻止其发生激活所需的构象变化,进而抑制受体激活(图4)。这一发现为深入理解GPCR家族的功能多样性提供了新视角。
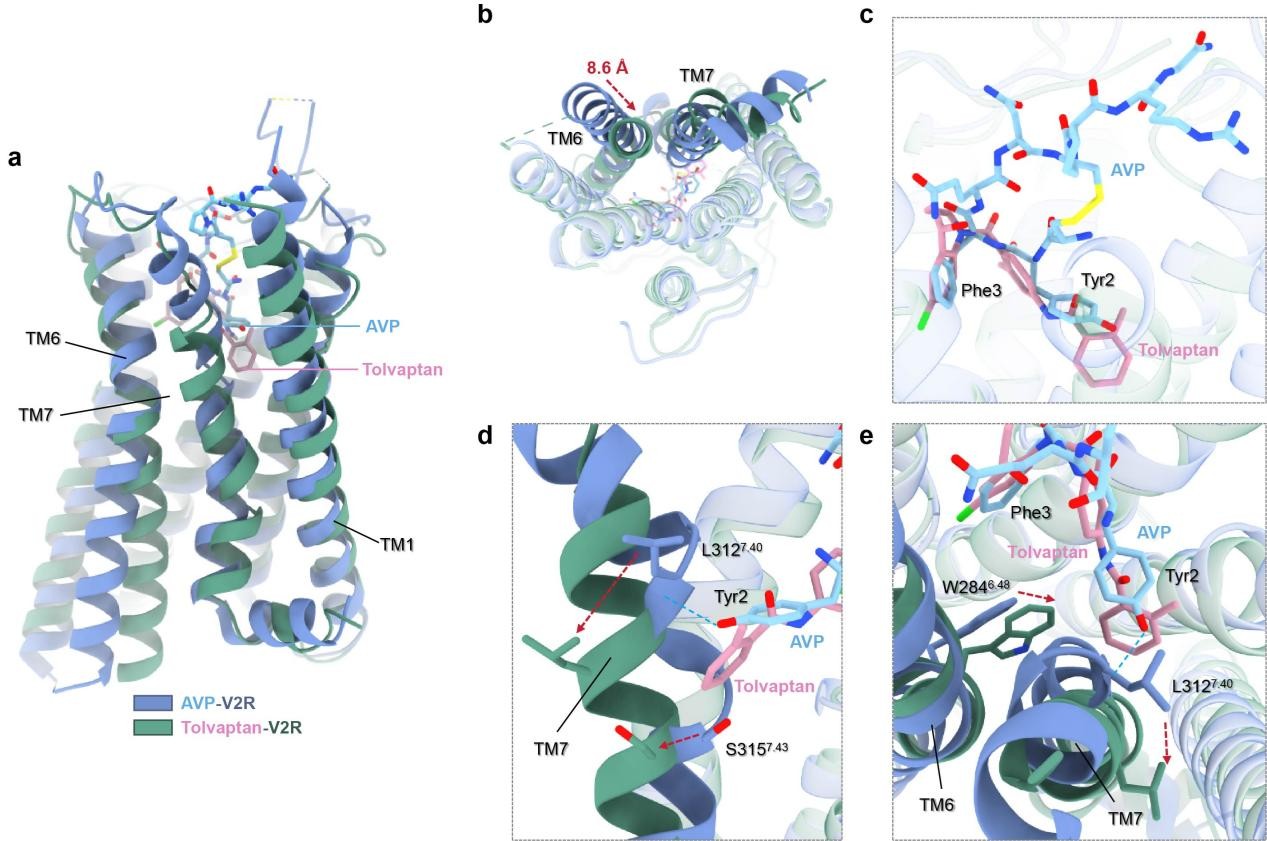
图4.非活性托伐普坦-V2R与活性AVP-V2R复合物的结构对比
该研究成果不仅深化了我们对人体水盐平衡调控机制的理解,更为设计更安全、高效、高选择性的新一代V2R拮抗剂奠定了关键结构基础,有望突破现有药物研发瓶颈,最终为水盐平衡紊乱类疾病提供更优的治疗方案。
我院郭栋教授与临港实验室蒋轶研究员和中国科学院上海药物研究所徐华强研究员为该研究的共同通讯作者。临港实验室与上海科技大学联合培养博士生章天炜、药学院青年教师刘宏丽和中国科学院上海药物研究所游宠昭博士为该论文的共同第一作者。
原文链接: https://doi.org/10.1038/s41467-025-64735-x
【初审:李桃春;复审:周雪妍;终审:韩爱侠】



